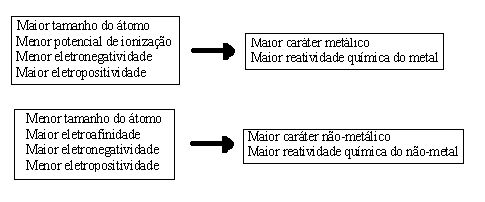
Também chamado de reatividade química, o caráter metálico de um elemento químico é a propriedade que esse elemento possui de reagir quimicamente. O caráter metálico ou não-metálico do elemento é consequência direta de uma série de outras propriedades. “O que chamamos de caráter metálico é, na verdade, um conjunto de propriedades baseadas no seguinte fato geral: um elemento é tanto mais metálico quanto maior é sua capacidade de perder elétrons”1.
Pode-se relacionar inúmeras propriedades ao caráter metálico dos elementos, o que pode ser observado no Esquema 1.
Desse modo, vemos que outras propriedades periódicas determinam o caráter metálico de um elemento químico. Assim, conforme a sua posição na tabela periódica tem-se um indicativo de sua tendência em reagir quimicamente. Na tabela periódica observa-se nas famílias um aumento de caráter metálico de cima para baixo e nos períodos da direita para a esquerda. O caráter não-metálico, obviamente, tem variação contrária, como mostra a Figura 1.
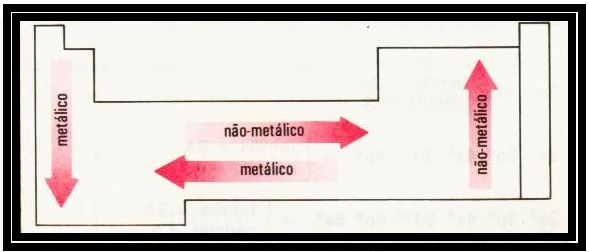
FIGURA 1. Variação do caráter metálico e não-metálico nas famílias e períodos da tabela periódica (1)
No sentido horizontal, os períodos da tabela periódica, conforme mostra a figura acima, o caráter metálico dos elementos decresce da esquerda para a direita, pois é neste sentido que decresce o tamanho dos átomos e aumenta sua energia de ionização. Dessa forma, o elemento químico sódio (Na) e o magnésio (Mg) são mais metálicos que o silício (Si), reagem quimicamente com maior facilidade, e o silício, por sua vez, é mais metálico do que o cloro (Cl). Os elementos de maior eletropositividade localizam-se na parte inferior esquerda da tabela periódica, e os não-metais mais característicos estão localizados na parte superior direita.
A eletropositividade representa o inverso da eletronegatividade. Os elementos fortemente eletropositivos formam compostos iônicos. Óxidos e hidróxidos dos metais são compostos básicos que se dissociam formando hidroxila. Abaixo é representado a dissociação aquosa do óxido de cálcio (CaO) e do hidróxido de sódio (NaOH), respectivamente.
CaO + H2O → Ca+2 + 2OH-
NaOH → Na+ + OH-
O grau de eletropositividade se manifesta de diversas maneiras. Elementos fortemente eletropositivos reagem com água e ácidos. Os metais apresentam sempre altas eletropositividades, pois uma de suas características é sua grande capacidade em perder elétrons. E, como foi discutido, entre o tamanho do átomo e sua eletropositividade há uma relação genérica, pois quanto maior o tamanho do átomo menor é a atração núcleo-elétron e, portanto, maior a sua facilidade em perder elétrons.
Referências:
1. SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.
RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
MAHAN, Bruce M.; MYERS, Rollie J.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP – 2002.
Texto originalmente publicado em https://www.infoescola.com/quimica/carater-metalico/