O modelo atômico de Rutherford-Bohr explicava de maneira satisfatória o comportamento do elétron no átomo de hidrogênio. Cientistas, ao tentar replicar a teoria nos elementos que possuíam mais elétrons, encontraram discrepâncias entre o postulado teórico e a realidade obtida nos espectros de emissão.
Os espectros de emissão de átomos com mais elétrons apresentavam uma singularidade: eram formados por um conjunto de linhas. A este conjunto denominou-se espectro de raia e a análise dos mesmos permitiu aos cientistas concluir que, uma vez excitados, elétrons de uma mesma camada apresentam comportamento espectral semelhante. Eles também intuíram sobre o nível de energia das camadas onde os elétrons circulavam, pois as linhas de uma raia apresentavam-se muito próximas, especulavam-se próximos os valores de energia.
Arnold. J. W. Sommerfeld, em 1916, interpretou espectros com múltiplas linhas justapostas e segundo ele, as camadas enunciadas por Bohr (K, L, M, N...) eram constituídas por subcamadas, de órbitas elípticas e de diferentes momentos angulares, conforme exibe a figura a seguir.
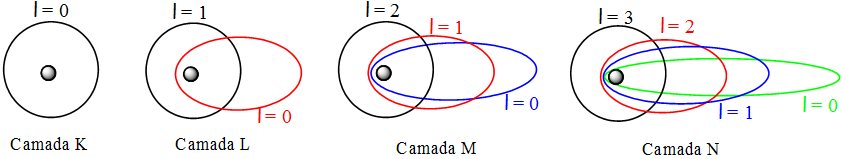
Modelo atômico de Sommerfeld (sem escala e em cores – fantasia)
As órbitas elípticas de Sommerfeld indicaram um segundo número quântico, denominado número quântico secundário (l). Este número quântico secundário, definido pela equação l = n – 1 descreveria as subcamadas de energia e por consequência, seu momento angular. Para a camada M (n=3) teremos para o valor do número quântico secundário l = 2. Conforme se observa na figura acima, teremos para a camada M três órbitas possíveis (0, 1 e 2), sendo a órbita de maior valor a mais arredondada e onde o elétron possuirá o maior nível de energia.
A proposta de Sommerfeld conseguira, através da instituição do segundo número quântico, explicar como os espectros de emissão apresentavam o fenômeno de linhas múltiplas nas raias espectrais. Segundo este modelo, as múltiplas linhas seriam os subníveis de energia que compõem o nível ou camada de energia e estes subníveis foram caracterizados como “s”, “p”, “d” e “f”, derivados de conceitos relativos à espectroscopia.
Sommerfeld, ao manter preceitos do modelo de Bohr, determinou intacta a natureza quântica do elétron. Os subníveis de energia explicavam a existência de espectros compostos por linhas justapostas, embora ainda se mantivessem dúvidas acerca de espectros obtidos sob a ação de intensos campos magnéticos.
Sob a ação de campos magnéticos, o espectro se decompõe, exibindo novas bandas espectrais. Para explicar o surgimento destas bandas, foi proposto que o elétron reagiria ao campo magnético acumulando determinado valor de energia e isso alteraria o seu momento magnético. Tal proposição permitiu a determinação do terceiro número quântico, o número quântico magnético (ml)
A análise dos espectros finos da primeira série de Balmer apontou a existência de duas linhas muito próximas. Foi proposto para este comportamento o quarto número quântico, o número quântico de spin (ms). Sendo o elétron uma partícula que possui um eixo imaginário, o mesmo executaria movimento de rotação sobre o mesmo, girando (spin) em dois sentidos: o paralelo e o antiparalelo. Esta concepção levou ao princípio de exclusão enunciado por Wolfgang Pauli, que indica não existir, em um mesmo átomo, dois elétrons iguais.
O físico francês Louis de Broglie, já em meados da década de 1920 afirmara que o elétron apresentaria a natureza “onda-partícula”, o que acabou por permitir a evolução do modelo Sommerfeld – Bohr.
Referências:
FELTRE, R; YOSHINAGA, S. Atomística – 1ª Ed. – São Paulo: Moderna, 1970. p. 126 – 147.
FELTRE, R. Química Geral – 5ª Ed. – São Paulo: Moderna, 2000. p.98 – 125.
Texto originalmente publicado em https://www.infoescola.com/quimica/modelo-atomico-de-sommerfeld/