O hidroxibenzeno, também conhecido como fenol, benzenol, ácido carbólico, ácido fênico, ácido fenílico e mono-hidroxibenzeno, é um dos compostos aromáticos mais simples. Em 1834, o químico alemão Friedlieb Ferdinand Runge extraiu a substância do alcatrão de hulha, dando origem ao termo Karbolsäure, que significa ácido de óleo de carvão.
Em 1841, Auguste Laurent produziu pela primeira vez fenol puro, onde os cristais brancos exalavam um odor característico de desinfetantes. O nome fenol foi atribuído pelo químico francês Charles Gerhardt, a partir do termo “phene” criado por seu colega Auguste Laurent.
Fenol é o nome atribuído a um dos grupos funcionais das funções oxigenadas, que são constituídas por átomos de carbono (C), hidrogênio (H) e oxigênio (O). É caracterizado pelo grupo hidroxila (-OH), ligado diretamente a um átomo de carbono do anel aromático, conforme indicado na figura abaixo:
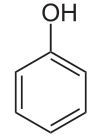
No início dos anos 1900, o benzeno proveniente do coque passou a ser precursor na fabricação de fenol, através do intermediário ácido benzenossulfônico. Contudo, o fenol pode ser produzido da oxidação parcial do benzeno, pelo processo do cumeno (isopropilbenzeno) ou pelo processo Raschig-Hooker. Atualmente, o benzeno é obtido por reformação catalítica ou cracking a vapor de petróleo, onde o fenol é sintetizado a partir do benzeno via isopropilbenzeno.
O hidroxibenzeno, com fórmula molecular C6H6O, massa molar 94 g/mol, aparência sólida, cristalina, coloração branca, caráter ácido fraco, por ser um monofenol, possui característica polar, com o vetor resultante no sentido do átomo de oxigênio mais eletronegativo. É capaz de se ionizar com a água formando o íon hidrônio, e reagir com bases originando sal e água. Adicionalmente, devido às ligações de hidrogênio apresentam temperatura de fusão e de ebulição altos, 40,8 ºC e 181,8 ºC, respectivamente.
Ionização do fenol: 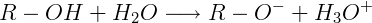
Reação com uma base: 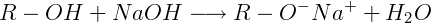
É incompatível com aldeídos, nitratos, nitritos. Na sua combustão ou decomposição térmica são produzidos gases tóxicos. Em altas concentrações é extremamente corrosivo, podendo causar queimaduras severas, e efeitos adversos quando inalado ou ingerido.
Os fenóis são versáteis, sendo considerados blocos de materiais, isto é, a partir dele pode-se produzir compostos mais complexos. Essa característica deve-se ao fato de um dos pares de elétrons do oxigênio do grupo hidroxila aumentar a densidade eletrônica dos elétrons deslocalizados no anel, tornando-o mais reativo que o benzeno. Desse modo, os átomos de hidrogênios podem ser substituídos por um composto eletrofílico como hidróxido de sulfonilo, halogenetos, grupos acilo, entre outros.
Devido à sua atribuição antisséptica, é empregado na fabricação de detergentes. Além disso, os fenóis são usados na preparação de resinas como a baquelite a partir da reação da serragem com o formaldeído, como precursor na produção de polímeros como policarbonatos e nylon, indicadores ácido-base, catalisador, na síntese de medicamentos, drogas e herbicidas.
Por ser precursor de diversas substâncias, o hidroxibenzeno é um composto importante na indústria de transformação. Apesar de não ser considerado carcinogênico, deve-se ter cuidado ao manuseá-lo, utilizando equipamentos de proteção individual.
Referências bibliográficas:
FONSECA, Martha Reis Marques da. Química: ensino médio. – 2. ed. – São Paulo: Ática, 2016.
NOVAIS, V. D. L. & ANTUNES, M. T. Vivá: química: volume 3: ensino médio. – Curitiba: Positivo, 2016.
SOLOMONS, T. W. G. Química Orgânica. Oitava ed. Rio de Janeiro: Livros Técnicos e Científicos, 2006. vol II
SOLOMONS, T. W. G.; FRYHLE, C. B. Química Orgânica 1. Sétima ed. - Rio de Janeiro: LTC, 2001.
http://pt.intoxication-stop.com/otravlenie-fenolom_html_default.htm
https://www.chemistryworld.com/podcasts/phenol/7699.article
http://www.hcrp.fmrp.usp.br/sitehc/fispq/Fenol.pdf
http://sites.ffclrp.usp.br/cipa/fispq/Fenol.pdf
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/hidroxibenzeno/