O benzeno, benzol ou cicloexatrieno, fórmula molecular C6H6, foi identificado pela primeira vez em 1825, pelo cientista inglês Michael Faraday, através de seus estudos com gás iluminante. Anos mais tarde, especificamente em 1834, o químico alemão Eilhardt Mitscherlich por meio do aquecimento do ácido benzoico, produziu benzeno. Em 1845, foi a vez do químico alemão A.W. Von Hofmann que isolou o benzeno a partir de alcatrão de hulha.
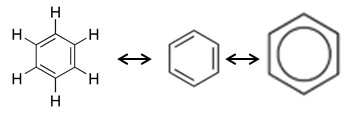
Desde então, a estrutura do benzeno passou a ser estudada. Desse modo, os químicos alemães Joseph Loschmidt (em 1861) e August Kekulé Von Stradonitz (em 1866), sugeriram uma fórmula estrutural com seis átomos de carbono com ligações covalentes simples e duplas alternadas, que posteriormente foi modificada por Kekulé, onde as ligações duplas realizavam oscilações entre os átomos do anel aromático, formando duas estruturas equivalentes.
Em 1931, o químico americano Linus Pauling propôs que o benzeno possuía uma estrutura única, que era um híbrido de ressonância das duas estruturas de Kekulé. De acordo com experimentos, as ligações covalentes simples (C-C) e duplas (C=C), apresentam comprimento de ligação 0,154 nm e 0,134 nm, respectivamente. Entretanto, todas as ligações entre carbonos no benzeno são iguais a 0,139 nm. Assim, a representação mais próxima do real da molécula de benzeno está representada conforme a figura:
A União Internacional de Química Pura e Aplicada (IUPAC) recomenda a utilização de uma das formas de ressonância para representar a molécula de benzeno, evitando a sua representação pelo seu híbrido de ressonância (hexágono com círculo no meio).
O benzeno é um líquido incolor ou amarelo claro à temperatura ambiente, com um odor doce, altamente inflamável, evapora no ar rapidamente, solúvel em etanol e clorofórmio, sendo ligeiramente solúvel em água (0,18%). Atualmente, o petróleo bruto é a principal fonte de benzeno. Contudo, pode-se encontra-lo nas emissões de gases de vulcões e incêndios florestais.
A partir do benzeno são fabricadas várias substâncias de uso industrial, por meio de técnicas de hidrogenação, sulfonação, nitração, acilação de Friedel-Crafts, alquilação de Friedel-Crafts, cloração e bromação. Sua atuação primordial é como solvente nas indústrias farmacêuticas e químicas, e como intermediário na síntese de produtos químicos.
O produto químico mais sintetizado é o etilbenzeno, que a partir da desidrogenação forma o estireno, e depois o poliestireno. O segundo maior uso é na produção de fenol. O benzeno também pode ser matéria-prima na produção de anilina, borrachas, lubrificantes, corantes, detergentes, drogas e pesticidas. Além de ser precursor das substâncias que posteriormente serão utilizadas na fabricação de plásticos, resinas, nylon e fibras sintéticas.
O benzeno é altamente tóxico, carcinogênico e mutagênico, sendo absorvido por meio do contato com mucosas, pele, inalação e ingestão. Atua diretamente no Sistema Nervoso Central (SNC), causando efeitos como dores de cabeça, vômitos, tonteiras, entre outros. Adicionalmente, sua exposição contínua causa anemia, leucemia e acidose metabólica.
É importante o investimento em medidas de proteção individual durante os processos de fabricação, assim como, uma fiscalização severa nos produtos que podem estar contaminados por benzeno e sua substituição nos processos por moléculas menos tóxicas.
Referências bibliográficas:
FONSECA, Martha Reis Marques da. Química: ensino médio. – 2. ed. – São Paulo: Ática, 2016.
NOVAIS, V. D. L. & ANTUNES, M. T. Vivá: química: volume 3: ensino médio. – Curitiba: Positivo, 2016.
SOLOMONS, T. W. G.; FRYHLE, C. B. Química Orgânica 1. Sétima ed. - Rio de Janeiro: LTC, 2001.
https://www.atsdr.cdc.gov/substances/toxsubstance.asp?toxid=14
https://www.cancer.gov/about-cancer/causes-prevention/risk/substances/benzene
https://www.britannica.com/science/benzene
Texto originalmente publicado em https://www.infoescola.com/quimica-organica/benzeno/