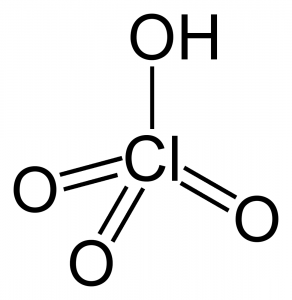
O ácido perclórico, de fórmula química HClO4, é um líquido oleoso incolor, inodoro, solúvel em água e mais denso que esta, considerado um super ácido. Também é conhecido como perclorato de dioxônio.
 Numa concentração acima de 72%, o ácido perclórico tende a explodir, e exatamente por isso que é muito difícil encontra-lo puro e, também por isso, é comercializado somente em solução aquosa, numa concentração de, no máximo, 70%. Em concentrações maiores que 70%, é comum a formação de um composto denominado anidrido perclórico (Cl2O7), o que logo poderá provocar uma explosão. As soluções de ácido perclórico são higroscópicas, isto é, nos casos em que não são devidamente isoladas do contato com o ar, se diluem absorvendo a umidade do ar, o que faz com que esse líquido transborde se deixado em recipiente aberto por muito tempo. Em contato com a maioria dos metais, forma gás hidrogênio inflamável.
Numa concentração acima de 72%, o ácido perclórico tende a explodir, e exatamente por isso que é muito difícil encontra-lo puro e, também por isso, é comercializado somente em solução aquosa, numa concentração de, no máximo, 70%. Em concentrações maiores que 70%, é comum a formação de um composto denominado anidrido perclórico (Cl2O7), o que logo poderá provocar uma explosão. As soluções de ácido perclórico são higroscópicas, isto é, nos casos em que não são devidamente isoladas do contato com o ar, se diluem absorvendo a umidade do ar, o que faz com que esse líquido transborde se deixado em recipiente aberto por muito tempo. Em contato com a maioria dos metais, forma gás hidrogênio inflamável.
Uma das formas de se obter o ácido perclórico é através da mistura do ácido nítrico com perclorato de amônio, reação que tem como produto o óxido nitroso e, é claro, o ácido perclórico. Também é possível produzi-lo (diluído) a partir de uma solução de perclorato com ácido sulfúrico concentrado.
É comum a utilização de ácido perclórico na fabricação de explosivos, por ser um forte oxidante. São nocivos a plantas, por isso têm aplicação na indústria química em produção de herbicidas. É empregado em laboratórios de Análises Clínicas nos exames de precipitação seletiva de mucoproteínas. Pode ser útil em algumas reações de eliminação de água.
A manipulação desse composto químico deve ser feita de maneira extremamente responsável, visto que acidentes podem causar sérios danos, se ingerido, provoca queimaduras no esôfago e no estômago, se inalado, causa irritação nas vias respiratórias, em contato com olhos e pele, pode causar sérias queimaduras. Em qualquer uma dessas situações, o médico deverá ser consultado imediatamente, e todas as suas orientações deverão ser seguidas.
Referências
http://pt.wikipedia.org/wiki/Ácido_perclórico
http://www.quimesp.com/index.php?page=shop.product_details&category_id=6&flypage=flypage.tpl&product_id=24&option=com_virtuemart&Itemid=54
http://sistemasinter.cetesb.sp.gov.br/produtos/ficha_completa1.asp?consulta=%C1CIDO%20PERCL%D3RICO
Texto originalmente publicado em https://www.infoescola.com/quimica/acido-perclorico/