Em 1923, Gilbert Newton Lewis colocou um fim no que ele chamava de “culto ao próton”, propondo uma definição para ácidos e bases, no mesmo ano em que foi proposta a definição de Brönsted-Lowry. A definição de Lewis consiste em:
- Ácido é toda espécie química que recebe pares eletrônicos isolados, formando ligações coordenadas (antigamente era chamada Dativa).
- Base é toda espécie química que cede pares de elétrons isolados, formando ligações coordenadas.
A definição de Lewis é a mais abrangente definição de ácidos e bases, em virtude de sua definição não se restringe somente as espécies hidrogênio e/ou hidroxila, mas se ajusta a praticamente todas as reações químicas. Um exemplo disso é o BF3, quando de sua reação com a amônia e segundo o mecanismo a seguir:
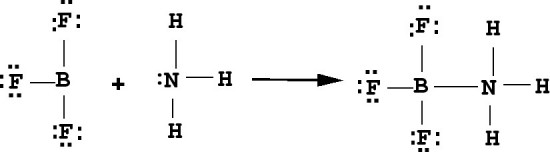 Esta reação mostra claramente que o BF3, funciona como um ácido de Lewis, por que ele é um átomo que viola a regra do octeto assim como os outros elementos da família 3A, em virtude de possuírem, apenas um sexteto de elétrons, podem receber um par eletrônico formando uma ligação covalente coordenada, esta é uma característica da definição de Lewis. E a amônia funciona como uma base segundo a definição de Lewis, por que ela apresenta um par de elétrons livre, então ela doa para o fluoreto de boro.
Esta reação mostra claramente que o BF3, funciona como um ácido de Lewis, por que ele é um átomo que viola a regra do octeto assim como os outros elementos da família 3A, em virtude de possuírem, apenas um sexteto de elétrons, podem receber um par eletrônico formando uma ligação covalente coordenada, esta é uma característica da definição de Lewis. E a amônia funciona como uma base segundo a definição de Lewis, por que ela apresenta um par de elétrons livre, então ela doa para o fluoreto de boro.
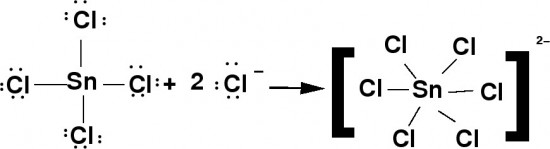
A definição de Lewis para ácidos e bases aplica-se perfeitamente para o cloreto de estanho (IV), ele funciona como um ácido forte de Lewis por que possui orbitais vazios, então ele recebe os pares eletrônicos, fornecidos pelo cloro expandindo sua valência. Por que na realidade o átomo de estanho está rodeado, por 12 elétrons ao invés de 8, formando um íon complexo com geometria Octaédrica e mais uma vez a regra do octeto é violada.
Essa definição é importantíssima principalmente em química orgânica visto que muitos compostos orgânicos funcionam como receptores e doadores de pares eletrônicos. Muitas espécies químicas podem funcionar como ácidos e bases de Lewis. O ácido é uma espécie deficiente de elétrons em busca de preenchimento para seus orbitais vazios e as bases são espécies em que sobram pares eletrônicos. É, no entanto, importante observar que a definição de ácido-base de Lewis sempre tende a formação de ligações covalentes coordenadas, por que sempre existe a doação e a recepção de pares eletrônicos.
Bibliografia:
SOLOMONS, T.W.G.; FRYHLE, C.B. Química Orgânica. Rio de Janeiro: LTC Editora. Vol. 1, 7.ed., 2001
SHRIVER, DUWARD; ATKINS, PETER. Química inorgânica - 4ª edição. Porto Alegre, Bookman, 2008.
Texto originalmente publicado em https://www.infoescola.com/quimica/acidos-e-bases-de-lewis/