Os alcóxidos são compostos onde temos um grupo orgânico R ligado a um átomo de oxigênio negativamente carregado, e podem ser escritos como RO.
Esses compostos podem ser formados pela reação de alcoóis com metais alcalinos e alcalinos terrosos.
2 CH3OH + 2 Na → 2 CH3O-Na+ + H2
Os alcóxidos também podem ser formados pela reação de alcoóis com íons hidreto H- e o íon amideto NH2-, que deslocam o hidrogênio do grupo OH.
R–O–H + H- →R–O- + H2
R–O–H + NH2- → R–O- + NH3
Os reagentes de Grignard também reagem com álcoois para formar alcóxidos.
H3C–CH2–OH + H3C–H2C–H2C–MgBr →
H3C–H2C–CH3 + H3C–CH2–O–MgBr
Observe que em todas as reações acima os álcoois (ácidos fracos) reagem com bases fortes, levando a formação do alcóxido, que é a base conjugada do álcool. Quando o grupo orgânico R não é muito volumoso, o alcóxidos é um nucleófilo e bom ligante. As reações de formação dos alcóxidos são de neutralização, e o por isso ele é considerado um sal. Dessa forma, apresenta propriedades semelhantes aos sais comuns, como cor, pontos de ebulição, fusão e solubilidades. Eles são relativamente solúveis em água e muito pouco solúveis em solventes orgânicos. Embora sejam pouco estáveis na água, são largamente utilizados como intermediários em diversas reações.
A química de alcóxidos é bastante atrativa devido à sua grande variedade de aplicações, que vão desde aplicações na química orgânica sintética a química de materiais.
Entre as diversas aplicações dos alcóxidos podemos destacar sua utilização na síntese de Williamso, que é realizada para a síntese de éteres.
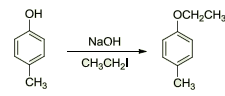
Figura 1: Síntese de Williamson.
Na reação acima temos um exemplo da utilização de um fenóxido, que diferem dos alcóxidos pelo fato do substituinte R ser um derivado do benzeno. Os fenóis são ácidos mais fortes que os álcoois, dessa forma os fenóxidos são bases mais fracas e menos nucleofílicas, fazendo com que esses compostos sejam mais fáceis de manusear.
Devido à suas propriedades ácido-base, os alcóxidos podem ser utilizados para promover reações de oxidação de álcoois, alilação de aldeídos e também como catalisadores de reações enantiosseletivas e da polimerização de lactonas por abertura de anel.
Os alcóxidos de metais de transição são amplamente usados para revestimentos e como catalisadores. Temos a utilização de alcóxidos formados pelos elementos silício, alumínio, zircônio e titânio que são largamente empregados na preparação de novos materiais via processo sol-gel. Através do processo sol-gel, podem ser obtidas cerâmicas, fibras, filmes finos e materiais híbridos com alta homogeneidade em nível molecular.
Os alcóxidos de silício apresentam uso mais intenso, o alcóxido genérico, Si(OR)4 , pode ser ilustrado na síntese da sílica, SiO2 onde ocorre a substituição dos grupos alcóxidos, pela ação nucleófila da molécula de água, para formar o correspondente álcool ROH.
Referencias:
Airoldi, C.; de Farias, R. F. Alcóxidos como precursores na síntese de novos materiais através do processo sol-gel. Química Nova, Vol. 27, No. 1, 84-88, 2004.
da Silva, I. M. C. B. Métodos de Preparação Industrial de Solventes e Reagentes Químicos. Revista Virtual Química. Vol 4 No.1 73-82.
Siddhartha Om Kumar Giese. Alcóxidos Homo- e Heterometálicos baseados em titânio e ferro como iniciadores da polimerização da caprolactona. Tese de Doutorado, Universidade Federal do Paraná, 2015.
Tito e Canto. Química na Abordagem do Cotidiano. Volume único, parte C – Química Orgânica. Editora Saraiva 2005.
T. W. Graham Solomons. QUÍMICA. ORGÂNICA volume 1; Sétima edição. Editora LTC livros técnico e científicos, 2000.
T. W. Graham Solomons. QUÍMICA. ORGÂNICA volume 2; Sétima edição. Editora LTC livros técnico e científicos, 2000.
Texto originalmente publicado em https://www.infoescola.com/quimica/alcoxidos/