O grau de ionização dos ácidos 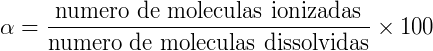 é determinado a partir da medida da condutibilidade elétrica de suas soluções iônicas. Neste caso conclui-se que ácidos mais ionizados permitem maior passagem de corrente elétrica em comparação aos ácidos menos ionizados, sendo esta a diferença que permite sua classificação. O grau de ionização determina algumas propriedades dos ácidos, principalmente aquelas que estão ligadas ao número de hidrogênios ionizáveis (H+), como é o caso do pH (potencial hidrogeniônico).
é determinado a partir da medida da condutibilidade elétrica de suas soluções iônicas. Neste caso conclui-se que ácidos mais ionizados permitem maior passagem de corrente elétrica em comparação aos ácidos menos ionizados, sendo esta a diferença que permite sua classificação. O grau de ionização determina algumas propriedades dos ácidos, principalmente aquelas que estão ligadas ao número de hidrogênios ionizáveis (H+), como é o caso do pH (potencial hidrogeniônico).
A importância de ácidos fracos não se encontra única e exclusivamente no setor de insumos industriais, surgindo também na figura das soluções tampão ou soluções tamponadas. Soluções tampão são muito importantes nos processos biológicos, pois inúmeras enzimas presentes nos organismos vivos só catalisam reações em uma estreita faixa de pH.
Mas a questão é: como um ácido fraco contribui na construção de uma solução tamponada? A resposta para este questionamento fortuito encontra-se na definição química de uma solução tampão: um ácido fraco e seu sal correspondente. Analisemos o exemplo mais clássico e acessível de sistema tampão: o sangue humano. Em nosso sangue encontram-se dissolvidas muitas substâncias químicas, dentre elas ácidos e bases fracas e, consequentemente, seus sais. O pH do sangue deve estar, em uma pessoa sadia, entre 7,35 e 7,45, sendo a variação destes valores algo extremamente perigoso ao organismo. A variação de aproximadamente ± 0,4 no pH do sangue pode levar o organismo aos quadros conhecidos como acidose (alta concentração de íons H+) e alcalose (baixa concentração de íons H+), podendo acarretar alterações drásticas no funcionamento normal do sistema nervoso, através de convulsões e espasmos musculares, culminando com o estado de coma e óbito.
O sangue é tamponado por três substâncias, embora abordemos somente o tampão H2CO3/HCO3- (ácido carbônico / sal acetato). Analisemos as equações a seguir:

Observemos os seguintes pontos:
- O ânion HCO3-(aq) é formado por ambos os sistemas em equilíbrio químico.
- O sal se dissocia completamente, mantendo seus íons presentes na solução.
- O ácido se dissocia pouquíssimo, pois seu α é baixo (1,3%), fazendo com o mesmo se mantenha em estado molecular (sem ionizar-se).
Logo, neste cenário “perfeito”, a adição de um ácido forte (e seus respectivos H+) deslocará o equilíbrio da equação 1 no sentido da regeneração do ácido carbônico, e não alterará a acidez do meio (seu pH). Se ocorrer o contrário, a adição de uma base forte, teremos a liberação dos ânions hidroxila (OH-), que reagirão com os cátions H+, formando água, o que também não altera o pH. Tal mecanismo se repete em nosso estômago, porém com outras substâncias.
Existem sistemas tamponados também em medicamentos, meios de cultura bacterianos e em tanques reativos, como os tanques onde ocorre a fermentação da garapa na produção de etanol.
A seguir observaremos a força dos principais ácidos inorgânicos e orgânicos, fornecendo também um pequeno prognóstico de suas utilizações no setor industrial.
| Ácido | Grau de ionização (α) | Qualificação quanto à força | Principal utilização |
| HF – ácido fluorídrico | 8% | Moderado | Gravação em cristais e vidros |
| H2CO3 – ácido carbônico | 0,18% | Fraco | Indústria de bebidas |
| HCN – ácido cianídrico | 0,008% | Fraco | Indústria química |
| H2S – ácido sulfídrico | 0,076% | Fraco | Indústria química |
| H2COOH – ácido acético | 3% | Fraco | Indústria alimentícia |
Leia também:
Referências bibliográficas:
LISBOA, J. C. F. Química, 2º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p. 206 – 208.
FELTRE, R. Físico – Química – 5ª Ed. – São Paulo: Moderna, 2000. p.304 – 325.
FELTRE, R. Química Geral – 5ª Ed. – São Paulo: Moderna, 2000. p.234 – 242.
LISBOA, J. C. F. Química, 1º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p. 276 – 283.
Texto originalmente publicado em https://www.infoescola.com/quimica/acidos-fracos/