Os álcoois (função álcool) são compostos que apresentam como grupo funcional a hidroxila (‒OH), ligados a carbonos saturados, em sua estrutura. Podem possuir insaturações, cadeias cíclicas e ramificações. Em geral são solúveis em água e até onze carbonos são líquidos.
Os álcoois podem ser considerados ácidos fracos pois, como o oxigênio é muito eletronegativo, atrai os elétrons da ligação para si e deixa o hidrogênio com caráter ácido. Isto faz com que os álcoois sejam capazes de realizar diversas reações.
Fórmula geral dos álcoois: R‒OH
Os álcoois podem ser classificados de acordo com o número de grupos hidroxilas presentes na estrutura:
- Uma hidroxila: monoálcool
- Duas hidroxilas: diálcool
- Mais de três hidroxilas: poliálcool
Exemplos:
| Monoálcool | Diálcool |
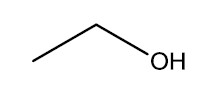 |
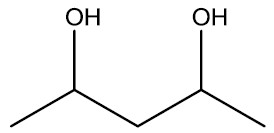 |
| Triálcool | |
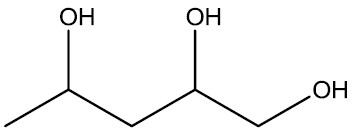 |
|
Uma outra forma de classificar os álcoois, é de acordo com o tipo de carbono ligado à hidroxila:
- Carbono primário: álcool primário
- Carbono secundário: álcool secundário
- Carbono terciário: álcool terciário
Exemplos:
| Álcool primário | Álcool secundário |
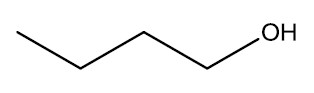 |
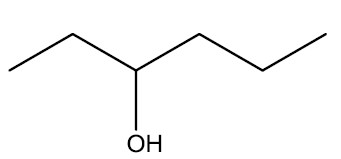 |
| Álcool terciário | |
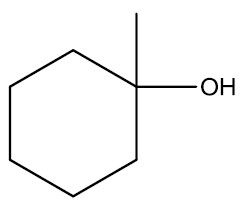 |
|
Conteúdo deste artigo
Nomenclatura dos álcoois
Prefixo + tipo de ligação + OL
Como nos álcoois há a presença de um grupo funcional, a contagem da cadeia principal deve iniciar na extremidade mais próxima da hidroxila.
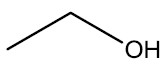
Etanol
Em estruturas que possuem mais de um grupo hidroxila, a contagem deve ser a que proporciona a menor numeração para estes grupos e, deve-se usar, os prefixos di, tri, tetra para designar a quantidade de hidroxilas.
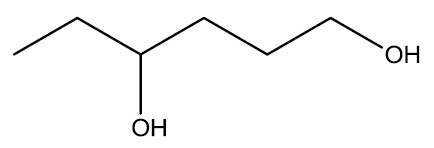
Hexan-1,4-diol
Em cadeias ramificadas, valem as regras na IUPAC, sendo a contagem da cadeia principal a que contenha a ramificação na menor numeração a partir da hidroxila.
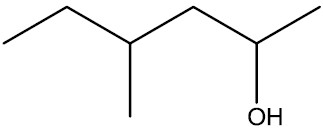
4-metil-hexan-2-ol
Em álcoois insaturados, em seus nomes devem constar as posições do grupo funcional, das insaturações e das ramificações, sendo esta a ordem de prioridade.
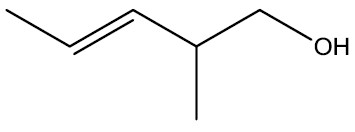
2-metil-pent-3-enol
No caso dos monoálcoois, há a possibilidade de utilizar uma nomenclatura usual, na qual o radical ligado ao grupo hidroxila é nomeado seguindo os prefixos e utilizando a terminação ÍLICO.
| Álcool etílico |
 |
| Álcool butílico |
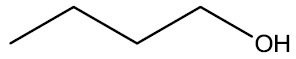 |
| Álcool isopropílico |
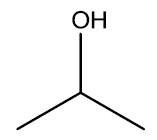 |
Alguns álcoois importantes
Álcool metílico (metanol)
O metanol (CH3OH) é um líquido inflamável de chama invisível, muito utilizado na fórmula Indy. Devido a característica de sua chama, as equipes de trabalho na área recebem treinamento especial para evitar acidentes. Seu manuseio exige cuidados especiais e cautela ao contato com a pele, pois o metanol causa irritação às membranas das mucosas, tendo efeito mais agressivo no sistema nervoso.
Álcool etílico (etanol)
O etanol (C2H5OH) é muito usado como combustível, principalmente em países mais tropicais, devido a sua baixa temperatura de operação e sua queima limpa em comparação à gasolina e ao óleo diesel, pois não libera compostos de enxofre na atmosfera. No Brasil, é obtido pela fermentação principalmente da cana-de açúcar, mas pode ser obtido de diversas outras fontes.
Colesterol
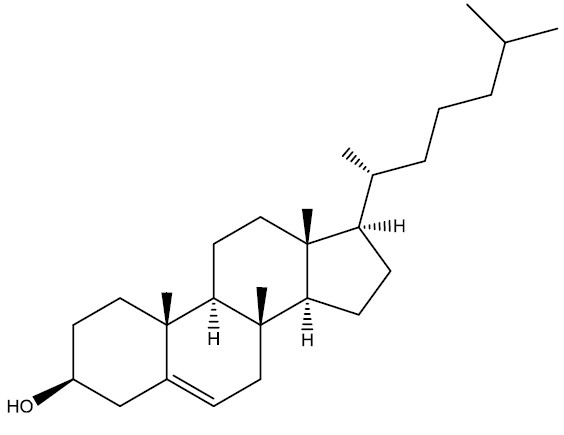
O colesterol (C27H45OH) é um esteroide que compõe as membranas celulares de todos os mamíferos, sendo transportado pelo plasma sanguíneo. É um álcool policíclico de cadeia longa, insolúvel em água e no sangue, e por esta razão, ao ser transportado, se liga a proteínas hidrossolúveis.
Leia também:
Bibliografia:
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/materiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica/alcoois/