A hidrólise é a quebra de uma molécula pela ação da água. A molécula de água libera para a solução íons H+ e OH- e quando uma molécula é quebrada um hidrogênio da molécula de água é transferido para um dos fragmentos dessa molécula, e a hidroxila para outro, com isso formando novos compostos.
XY + H2O → HY + XOH
Essa ação da água não acontece sozinha, para isso são necessárias pressão e temperatura elevada. Além disso, para aumentar a velocidade deve-se utilizar um agente acelerador, um catalisador, sendo que os mais importantes são ácidos, enzimas e álcalis.
A hidrólise tem aplicações tanto em reações orgânicas quanto inorgânicas. De maneira geral podemos destacar as reações de saponificação de ácidos graxos, inversão de açúcar, preparação de álcoois e ácidos a partir de ésteres, hidrólises de produtos naturais como amidos, glicosídeos, proteínas.
É importante ressaltar que não se deve confundir o processo de hidrólise com a desidratação, já que no primeiro a quebra da ligação na molécula se dá pela presença da água, enquanto que no segundo processo ocorre a formação de moléculas de água. A hidrólise pode ser do tipo alcalina, ácida, salina ou enzimática.
A hidrólise alcalina ou básica ocorre na presença de uma base em solução aquosa, podendo ser diluída ou concentrada. A base é utilizada no lugar da água, pois libera OH- e ao final reação têm-se como produtos um sal e um ácido. Dentre as aplicações da hidrólise básica estão às reações de formação de ésteres, hidrólise de amostras de sedimentos, digestão de materiais orgânicos utilizando os hidróxidos de potássio (KOH) ou sódio (NaOH) e reação de despolimerização da garrafa PET.
A hidrólise ácida ocorre na presença de um ácido mineral em solução aquosa, podendo ser diluída ou concentrada. Os principais ácidos utilizados são o ácido sulfúrico (H2SO4) e o ácido clorídrico (HCl), porém podem ser utilizados também em alguns casos o ácido nítrico (HNO3) e fosfórico (H3PO4). Dentre as aplicações da hidrólise ácida estão às reações que envolvem ésteres, amidas e açucares. Um exemplo prático é a descromagem ácida, que consiste na remoção de cromo presente em resíduos de couro antes do descarte evitando a contaminação de solos ou dos lençóis freáticos.
A hidrólise enzimática ocorre na presença de enzimas, que funcionam como catalisadores, aumentando a velocidades das reações, pois promove a diminuição da energia de ativação (energia necessária para iniciar a reação). Quando comparando com as hidrólises ácida e básica apresenta vantagem de ser especifica, ter controle do grau de hidrolise, condições de reação mais moderadas, menores concentrações de reagentes. Alguns exemplos de aplicação são na quebra de proteínas (proteases, que auxiliam na quebra das ligações peptídicas), hidrólise de óleos e gorduras, (lípases, quebra moléculas de lipídeos em colesterol, ácidos graxos e glicerol), digestão de carboidratos (sacarase, quebra a sacarose em glicose e frutose) e hidrólise enzimática de biomassa para produção de etanol.
A hidrólise salina é definida como a reação entre molécula de um sal e água.
YX(s) + H2O(l) ↔ Y(aq)+ + X(aq)-
Os íons que formam o sal, quando reagem com a água que tem caráter anfótero, podem resultar em uma solução ácida, básica ou neutra.
Formação de uma solução de caráter ácido:
H+ + H2O ↔ HOH + H+
Formação de uma solução de caráter básico:
OH- + H2O ↔ HOH + OH-
Os ácidos ou bases formados são de caráter moderado ou fraco. É possível calcular o grau (α) e a constante de uma hidrólise (Kh) conforme descrito a seguir:
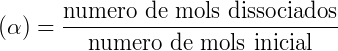
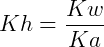
Onde Kw = constante de dissociação da água e Ka = constante de dissociação do ácido.
Entre as aplicações da hidrólise salina podemos destacar o tratamento de águas, e análises quantitativas diversas utilizadas em laboratórios de pesquisa e indústrias.
Referencias
Bente, V. L. I. Hidrólise básica de resíduos poliméricos de PET pós consumo e degradação catalítica dos monômeros de partida. Dissertação, Universidade Federal do Amazonas, 2008.
Fatibello-Filho, O.; Wolf, L. D; Assumpção, M. H. M.T.; Leite, O. L. Experimento Simples e Rápido Ilustrando a hidrólise de sais. Química Nova na Escola n. 24, novembro, 2006.
Hijazin , C.A. H; Simões, A. T..Hidrólise ácida, alcalina e enzimática Silveira. R. D.Revista Atitude - Faculdade Dom Bosco de Porto Alegre • Ano IV • Número 7, Janeiro - Junho de 2010.
Jumelice dos S. SilvaI; Valéria R. dos S. Malta; Martha S. R. dos Santos-Rocha; Renata M. R. G. Almeida; Márcia A. Gomes; Cecília D. Vicente; Kledson L. Barbosa. Hidrólise enzimática, fermentação e produção de biocombustíveis através da coroa de Ananas comosus.Química Nova, Vol. 41, No. 10, 1127-1131, 2018.
Kotz, J. C. Química Geral e Reações Químicas. Volume 2, 9ª edição, Cengage Learning, 2015.
Tito e Canto. Química na Abordagem do Cotidiano. Volume único, partes A e C – Química Orgânica. Editora Saraiva 2005.
Texto originalmente publicado em https://www.infoescola.com/reacoes-quimicas/hidrolise/